Коагулограмма (скрининг)
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Напоминаем вам, что самостоятельная интерпретация результатов недопустима, приведенная ниже информация носит исключительно справочный характер.
Коагулограмма (скрининг): показания к назначению, правила подготовки к сдаче анализа, расшифровка результатов и показатели нормы.
Показания к назначению исследования
Коагулограмма (гемостазиограмма) – комплексное гематологическое исследование, направленное на оценку состояния системы гемостаза (свертывание крови), или показателей свертывания крови. В систему гемостаза входят клетки крови (тромбоциты) и специфические вещества (факторы свертывания), растворенные в плазме крови и содержащиеся в тромбоцитах. При нарушении целостности стенки сосуда происходит активация свертывающей системы и образуется сгусток крови, препятствующий кровопотере.
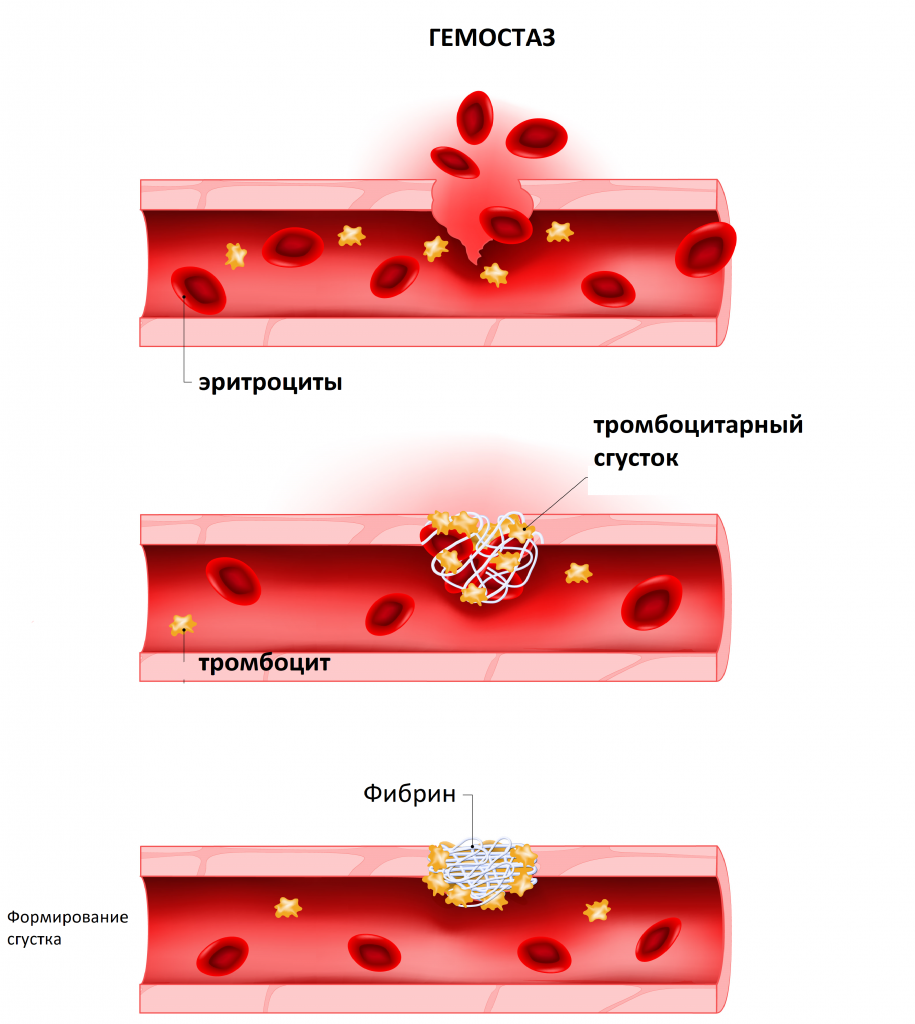
Через некоторое время после остановки кровотечения начинается фибринолиз – процесс растворения тромба после восстановления поврежденной стенки сосуда для возобновления тока крови.
Показаниями к проведению коагулограммы являются состояния, сопровождаемые повышенной кровоточивостью или, наоборот, повышенным тромбообразованием.
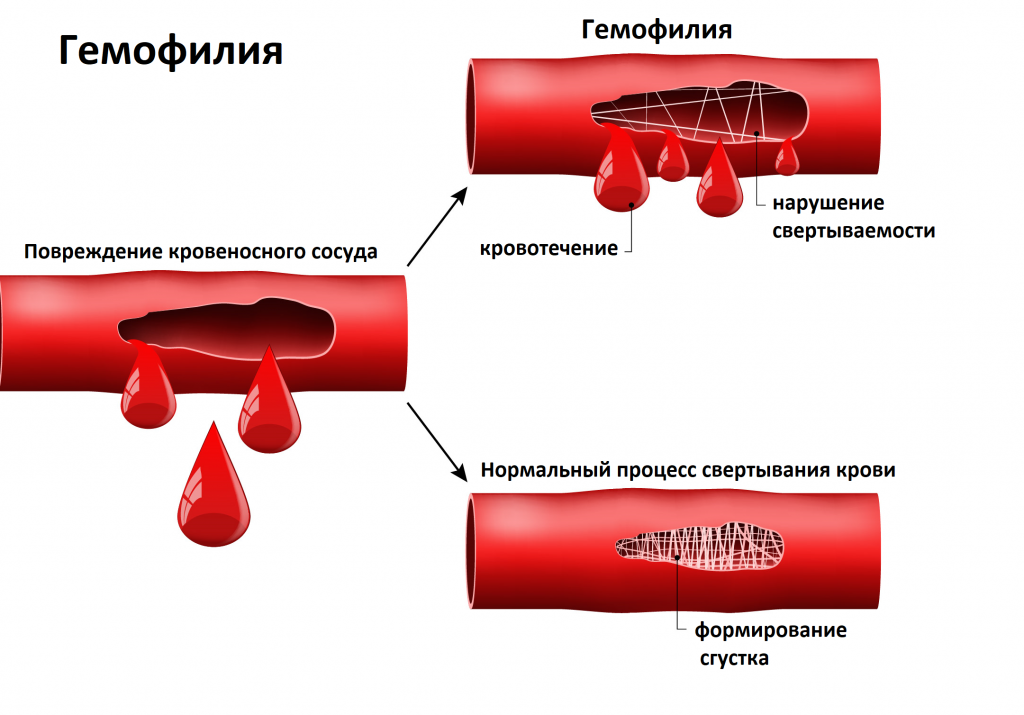
Повышенная кровоточивость приводит к геморрагическому синдрому. Он проявляется образованием гематом, точечных кровоизлияний под кожу (петехий), кровоточивостью слизистых оболочек (носовые кровотечения, кровотечения из десен), появлением примеси крови в кале, моче, длительными менструальными кровотечениями, а также возможными кровоизлияниями во внутренние органы и полости тела. Наиболее грозным проявлением геморрагического синдрома является кровоизлияние в головной мозг – геморрагический инсульт, который может привести к стремительному нарушению функции мозга вплоть до летального исхода. Наследственное заболевание, связанное с нарушением свертывания крови (уменьшение или отсутствие факторов свертывания) называется гемофилия.
Обратная ситуация – тромбоз – это формирование внутри кровеносных сосудов сгустков крови (тромбов), препятствующих свободному току крови.
Риск повышенного тромбообразования имеют люди с ожирением, сахарным диабетом, нарушениями ритма сердца (среди которых наиболее значимы фибрилляция и трепетание предсердий), низкой двигательной активностью, пациенты после крупных операций (например, протезирования суставов, клапанов сердца, экстренных операций и т. п.), с варикозной болезнью, перенесенными инфарктами миокарда, инсультами, с различными аутоиммунными заболеваниями.
Тромбообразование в определенном участке сосудистого русла сопровождается острым или постепенным нарушением кровоснабжения какого-либо органа с нарушением его функций и последующим некрозом тканей.
Помимо вышеперечисленных состояний, коагулограмму выполняют перед операциями для оценки риска кровотечений, при назначении некоторых лекарственных препаратов, а также обязательно при заболеваниях печени, поскольку большая часть белков системы свертывания крови синтезируется именно в этом органе.
Подготовка к процедуре
Суть коагулограммы – оценка активности белков свертывающей системы крови. Поэтому крайне важна правильная подготовка к сдаче данного анализа. Взятие крови осуществляется натощак, последний прием пищи должен быть не менее чем за 8-10 часов до сдачи анализа. Рекомендуется исключить избыточное количество жирной, сладкой и белковой пищи. Питьевой режим остается обычным. Накануне необходимо избегать стрессовых нагрузок, интенсивных занятий спортом.
Если пациент принимает какие-либо лекарственные препараты, влияющие на показатели коагулограммы, то в зависимости от поставленных перед исследованием целей необходимо или продолжить, или за несколько дней прекратить их прием. Это следует обязательно обсудить с лечащим врачом до сдачи анализа.
При необходимости срочного получения результатов можно обратиться в офисы компании ИНВИТРО, где проводится экспресс-диагностика. В этом случае анализ будет готов примерно через 2 часа.
Некоторые из белков свертывающей системы крови относятся к белкам острой фазы. Они вырабатываются во время стресса, к которому относятся не только физическая и эмоциональная нагрузка, но и болезни. Следовательно, любое стойкое или непродолжительное, но интенсивное напряжение организма может приводить к изменению показателей коагулограммы.
Обезвоживание (дегидратация) является одной из причин сгущения крови и увеличения концентрации факторов свертывания, что также приводит к искажению результата.
Состояние свертывающей системы крови меняется во время беременности, как в сторону усиления, так и в сторону ослабления активности ряда белков.
Применение многих лекарственных средств влияет на свертывающую систему крови. Так, первые поколения оральных контрацептивов приводят к повышенному риску тромбообразования, а антикоагулянты – к кровотечениям. Список препаратов, действующих на активность свертывающей системы, огромен. При получении какой-либо медикаментозной терапии предварительно следует проконсультироваться с лечащим врачом о возможном влиянии конкретного препарата на результат исследования.
Прием беременной женщиной некоторых лекарственных препаратов, например, варфарина, рифампицина, фенитоина, барбитуратов, сказывается на выработке факторов свертывания в организме плода. Впоследствии ребенок может быть подвержен высокому риску кровотечений.
Свёртываемость крови
Многие начинают бояться тромбов после того, как при сдачи крови из вены медсестра сообщает, что она слишком вязкая. Те же, кто обладает слишком жидкой кровью, успешно наполняющей пробирку, надеются, что застрахованны от тромбоза. Но вязкость и свёртываемость – два совершенно разных понятия, и не всегда одно обуславливает другое.
Какая ты вязкая
Повышенная вязкость крови, из-за которой она становится менее текучей, чаще всего возникает из-за преобладания её форменных элементов над жидкими. Происходит это из-за слишком строгого следования рекомендациям «не есть за 12 часов до сдачи анализа» и из-за решения добавить к этому ограничению ещё одно – не пить. Чтобы уж наверняка. В итоге получается хуже – и кровь плохо течет в пробирку, и некоторые показатели (например, гемоглобин, гематокрит, общее число эритроцитов, лейкоцитов и тромбоцитов) оказываются искусственно завышенными. Поэтому важно помнить: перед сдачей анализов крови нельзя ограничивать себя в жидкости.
Ещё одна частая причина повышенной вязкости – повышенный уровень эритроцитов и гемоглобина, характерный для курильщиков. Ведь чем больше дыма и меньше воздуха человек вдыхает, тем большая концентрация переносчиков кислорода необходима. Формируется их компенсаторное повышение. Поэтому визуально кровь курящих нередко кажется более вязкой.
По свидетельству гематологов, на долю истинных заболеваний (тромбоцитозы, эритроцитозы и т.д.) связанных с повышенной вязкостью крови, приходится незначительное число всех случаев «вязкой крови». И это хорошо видно по обычному общему анализу крови – врач сразу же обратит внимание на слишком высокое число эритроцитов или тромбоцитов.
В норме содержание эритроцитов крови составляет 3,7-5,1, тромбоцитов – 180-320.
Вязкость и свёртываемость – в чём разница?
Наиболее важным показателем является свёртываемость крови. К сожалению, получить точную информацию о свёртываемости, даже, несмотря на уровень развития медицины, бывает непросто. С одной стороны давно известны явные заболевания с нарушением свёртываемости, такие как гемофилия. С другой, немало скрытой патологии, которая может долгое время никак себя не выдавать, но проявившись однажды, быстро привести к тяжёлым последствиям.
Лишь в последние десятилетия исследователи научились выявлять эти проблемы с помощью высокотехнологичных генетических анализов. Учитывая, что по статистике врождённая патология свёртывающей системы крови есть у более 1-3% населения Земли, вполне вероятно, что в будущем эти анализы будут проводить в роддоме каждому новорожденному. И совершено точно тем, кому необходимо назначить те или иные лекарства, способные усилить риск появления тромбов.
Предохранение или опасность?
Например, это очень важно сделать перед назначение гормональных контрацептивов. Их способность усиливать свёртываемость крови и изредка приводить к тромбозам (как выясняется, почти всегда это происходит у женщин, имеющих скрытое нарушение свёртываемости) известна несколько десятилетий. В связи с широким распространением этого метода защиты от нежелательной беременности в наши дни частота тромбозов у молодых, внешне здоровых женщин возросла. При этом, назначая «КОКи» гинекологи нечасто акцентируют внимание пациенток на этой опасности. Их можно понять – осложнение в общей массе нечастое, а лишний раз запугивать пациенток, словно подталкивая их к нежелательной беременности, не хочется. Тем временем наиболее передовые западные коллеги уже включили полное исследование свёртываемости крови в обязательный алгоритм обследования перед назначением гормональных контрацентивов.
Что покажет анализ?
Какие же анализы необходимо сдать, чтобы проверить свёртываемость крови? Самый распространённый и многим привычный анализ – коагулограмма может дать ответ далеко не на все вопросы, особенно в профилактике тромбозов.
Тем не менее, классическая коагулограмма – первый этап скринингового обследования системы свёртываемости. Если она выявит отклонения от нормы, следующим шагом станут более детальные исследования гемостаза – тромбоэластография или тромбоэластометрия. Отдельная история – определение D-димера, мутации Лейдена и других генетических нарушений свёртывания – тесты, выявляющие склонность к образованию тромбов в будущем. Что и в каких случаях необходимо?
Самая распространённая сегодня стандартная коагулограмма включает в себя пять компонентов: ПТИ ( протромбиновый индекс); МНО ( Международное нормализованное отношение. Отражает отношение времени свёртываемости крови пациента к времени свёртывания крови здорового пациента; АЧТВ (активированное частичное тромбопластиновое время. Оценивает время, за которое образуется сгусток крови после присоединения к плазме специальных реагентов), УРОВЕНЬ ФИБРОГЕНА и ТРОМБОЦИТОВ.
При этом АЧТВ информативен лишь у людей, проходящих лечение гепарином, а МНО важен только для людей, постоянно принимающих разжижающие кровь препараты из группы неодикумаринов (варфарин).
Получается, два показателя из пяти не так важны для скрининга. Общее количество тромбоцитов также не всегда показательно, ведь при большинстве коагулопатий изменяется не их число, а прежде всего функциональная активность.
Поэтому наиболее информативным, позволяющий оценить сразу несколько звеньев свёртывания крови – тромбоэластография. Это своего рода детальное наблюдение за формированием кровяного сгустка, и его последующего растворения (лизиса) с построением графиков каждого из этапов. Тромбоэластометрия – другой вариант этого исследования, считающийся ещё более информативным. К сожалению, приборы для проведения этих исследований дороги и требуют специального обучения персонала, поэтому предложить услуги тромбоэластографии может далеко не каждая лаборатория.
Ещё один важный показатель – D-ДИМЕР (это продукт распада фибрина, небольшого фрагмента белка, присутствующего в крови после разрушения тромба).
Он активно используется для определения риска тромбообразования. Те, у кого D-димер даже незначительно повышен, рискуют столкнуться с появлением тромбов значительно больше остальных. Контролировать D-димер необходимо при заболеваниях вен (тромбофлебиты), после проведенных оперативных вмешательств и при выписке из стационара, если вы были долго прикованы к постели. наблюдать за уровнем D-димера полезно во время беременности и при приеме гормональных контрацептивов (риск образования тромбов при наличии мутации Лейдена на фоне приема противозачаточных таблеток возрастает почти в 9 раз). А теперь и во время COVID-19 и несколько недель после выздоровления.
Сегодня в дополнение к определению D-димера появляются генетические тесты на врожденные нарушения свертываемости крови. Самая частая из них – мутация Лейдена, которая встречается у 2–6% европейцев. Наличие дефектного гена в 6–8 раз повышает вероятность венозных тромбов, значительно возрастает риск инфаркта и инсульта. Но и другие мутации, которых сегодня насчитывается более десяти, не менее опасны. При этом вовремя начатая профилактика тромбозов (главным образом постоянный приём антикоагулянтов, исключение некоторых продуктов и лекарств, ношение компрессионного трикотажа при авиаперелётах и работе «на ногах» т.д.) снижает риск опасных осложнений в десятки раз.
Мерцающая проблема
Если со свёртывающей системой всё в порядке, возможной причиной повышения свёртываемости может оказаться аритмия, а именно – мерцание предсердий. По статистике, пароксизмальной (протекающей приступами) или постоянной формой
мерцательной аритмии страдают 2% населения планеты.
Обычно эта проблема появляется после тридцати. Субстрат нарушения — появление патологических завихрений электрического импульса в предсердиях, которые дают миокарду внеочередные электрические стимулы. На медицинском языке это называется механизмом «re-entry» или повторного
входа возбуждения. В результате предсердия превращаются в маслобойку, которая взбивает кровь в тромбы, словно молоко в масло. Ещё больше ситуация ухудшается в случае, когда у человека исходно были те самые нарушения свёртываемости. Тромбы могут образоваться уже через 48 часов после развития приступа и «улететь» в артерии головного мозга, вызвав ишемический инсульт, в кишечник, приведя в мезентериальному тромбозу, в артерии конечностей, спровоцировав их острую ишемию.
Фактор Виллебранда и COVID-19.
Тяжёлое течение COVID-19 может быть связано с повышенным уровнем одного из факторов свёртывающей системы крови – фактором Виллебранда. Такую гипотезу выдвинула старший научный сотрудник лаборатории биологии амилоидов СПбГУ Анна Аксёнова. Ее научная статья опубликована в журнале «Экологическая генетика». Уже доказано, что вирус SARS-Cov-2 способен оказывать прямое повреждающее воздействие на внутреннюю стенку сосудов. В ответ на повреждение организм стремится как можно быстрее «залатать» пробоину, и ведущую роль в этом играет фактор Виллебранда, участвующий в активации тромбоцитов и, по сути, запускающий процесс местного тромбообразования. В ходе исследований выяснилось, что для некоторых людей характерна повышенная концентрация этого фактора в клетках, так, его, как правило, больше у людей со II группой крови. Также возможна индивидуальная особенность организма. В результате в ответ на массивное микроповреждение сосудов возникает массивный микротромбоз, который вызывает появление более крупных и опасных тромбов.
Генетические мутации системы свёртывания, выявляемые в ходе анализов:
МУТАЦИЯ V КОАГУЛЯЦИОННОГО ФАКТОРА СВЁРТЫВАЕМОСТИ КРОВИ (ФАКТОР ЛЕЙДЕНА)
ИНГИБИТОР АКТИВАТОРА ПЛАЗМИНОГЕНА 1
МУТАЦИЯ II КОАГУЛЯЦИОННОГО ФАКТОРА (МУТАЦИЯ ПРОТРОМБИНА)
МУТАЦИЯ МЕТИЛЕНТЕТРАГИДРОФОЛАТРЕДУКТАЗЫ (MTHFR C677T)
МУТАЦИЯ VII КОАГУЛЯЦИОННОГО ФАКТОРА СВЁРТЫВАЕМОСТИ КРОВИ (F7 ARG353GLN)
ПОЛИМОРФИЗМ ГЕНА РЕДУКТАЗЫ МЕТИОНИНСИНТАЗЫ (MTRR A66G)
МУТАЦИЯ ФИБРИНОГЕНА, БЕТА (FGB G-455A)
МУТАЦИЯ ПРОМОТОРА ГЕНА КОАГУЛЯЦИОННОГО ФАКТОРА FVII (-312 INS 10BP)
ИНСЕРЦИЯ/ДЕЛЕЦИЯ ALU-ЭЛЕМЕНТА В ГЕНЕ АНГИОТЕНЗИН-ПРЕВРАЩАЮЩЕГО ФЕРМЕНА (ALU INS/DEL)
МУТАЦИЯ ТРОМБОЦИТАРНОГО ГЛИКОПРОТЕИНА 1B, АЛЬФА СУБЪЕДИНИЦЫ
МУТАЦИЯ АДФ-РЕЦЕПТОРА ТРОМБОЦИТОВ (P2RY12 H1/H2)
МУТАЦИЯ A1298С ГЕНА МЕТИЛЕНТЕТРАФОЛАТРЕДУКТАЗЫ
D-димер значительно повышается у большинства больных со среднетяжёлым и тяжёлым течением COVID-19. Поэтому все пациенты получают лечебные дозы антикоагулянтов.
Мутация Лейдена – наиболее частое скрытое нарушение свёртываемости крови, встречается у 2-6% европейцев.
Факторы свертывания крови – значение и функции элементов, этапы коагуляции
Фибриноген
Синтезируется в печени, разрушается в лёгких. Норма: 2-4 г/л
Протромбин
Синтезируется в печени, снижается при дефиците вит.К. Норма: 0,1 г/л
Тканевой тромбопластин
Термостабильный липопротеид, содержится во многих органах. Существует в виде предшественника – протромбластина.
Ионы кальция
Участвуют во всех фазах свёртывания. Норма: 0,09-0,1 г/л
Проакцелерин
Синтезируется в печени, не зависит от витамина К. Норма: 0,01 г/л
Акцелерин
Сывороточный АС-глобулин. Активная форма фактора V.
Проконвертин
Синтезируется в печени при участии витамина К. Норма: 0,005 г/л
Антигемофильный глобулин А
Синтезируется в печени. Учавствует в формировании протромбиназы. Норма: 0,01-0,02 г/л
Фактор Кристмаса
Синтезируется в печени. Учавствует в формировании протромбиназы. Норма: 0,003 г/л
Фактор Стюарта-Прауэра
Синтезируется в печени. Учавствует в формировании протромбиназы. Норма: 0,01 г/л
Фактор Розенталя
Синтезируется в печени, является предшественником тромбопластина. Норма: 0,005 г/л
Фактор Хагемана
Фактор контакта, синтезируется в печени в неактивном состоянии. Норма: 0,03 г/л
Фибринстабилизирующий фактор
Фибриназа, плазменная трансглутаминаза. Принимает участие в формировании плотного сгустка. Норма фибринстабилизирующего фактора составляет 0,01-0,02 г/л
- Для общей оценки свертывающей системы крови
- Для исследования активности свертывающих факторов
- Для исследования белковосинтезирующей функции печени
- Для оценки риска сердечно-сосудистых заболеваний
- Для обследования перед оперативным вмешательством
- Для диагностики причин невынашивания беременности
- Для диагностики ДВС-синдрома, венозного тромбоза, антифосфолипидного синдрома, гемофилии и оценки эффективности их лечения
- Пациенты с подозрением на ДВС-синдром, тромбоэмболию легочной артерии
- Пациенты, планирующие хирургические вмешательства;
- Пациенты с тромбозами, тромбоэмболиями
- Пациенты с тяжелыми заболеваниями печени
- Пациентки с повторяющимися выкидышами
- Пациенты, применяющие антикоагулянты
- Пациенты с обнаруженными волчаночными антителами и антителами к кардиолипину;
- Пациенты с наследственной предрасположенностью к нарушениям системы гемостаза;
- Пациенты, находящиеся в группе риска сердечно-сосудистых заболеваний и тромбоэмболий;
- Пациенты с носовыми кровотечениями, кровоточивостью десен, кровью в стуле или моче, кровоизлияниями под кожу и в крупные суставы, хроническими анемиями, обильными менструальными выделениями, внезапной потерей зрения.
Медицинский центр репродуктивного здоровья имеет возможность проводить не только скрининговые тесты, дающие информацию о нарушениях свертывания крови, но и определять конкретные компоненты коагуляционного каскада, противосвертывающей системы и фибринолиза.
- Протромбиновое время (ПВ)
Показатель, определяемый для оценки внешнего пути свёртывания крови. Причиной увеличения ПВ может стать нарушение функции печени, применение варфарина. Является основным методом контроля терапии непрямыми антикоагулянтами.
- Международное нормализованное отношение (МНО)
показатель, позволяющий оценить состояние внешнего пути свертывания крови. Это стандартизованный в соответствии с международными рекомендациями показатель протромбинового теста. Используется при оценке системы гемостаза в целом, эффективности терапии варфарином, степени нарушения печеночной функции.
- Фибриноген
фактор свертывания крови I, вырабатывающийся в печени. Превращается в фибрин, который участвует в образовании кровяного сгустка и тромба. Дефицит фибриногена проявляется нарушением образования стабильного тромба и повышенной кровоточивостью. Его концентрация в крови повышается при заболеваниях, сопровождающихся повреждением тканей и воспалением.
- Активированное частичное тромбопластиновое время (АЧТВ, АПТВ)
характеризует внутренний путь свертывания крови. Его увеличение связано с повышенным риском кровотечений, уменьшение – с тромбозом. Данный показатель отдельно используют для контроля терапии прямыми антикоагулянтами (гепарином).
- Растворимые фибрин-мономерные комплексы (РФМК)
маркер тромбинемии при внутрисосудистом свертывании крови. Исследуется для диагностики тромбозов и ДВС-синдрома, мониторинга гепаринотерапии, определения ее эффективности и достаточности, перед хирургическими вмешательствами.
Волчаночный антикоагулянт увеличивает риск появления тромбов в венах и артериях (чаще всего в венах ног – тромбоз глубоких вен). Такие тромбы способны блокировать ток крови в любой части тела, что может приводить к сердечным приступам, инфарктам, эмболии легких, а также к самопроизвольным абортам на поздних сроках.
Исследование назначают для выявления причин тромбоза, самопроизвольных выкидышей, при повышении АЧТВ, при диагностике антифосфолипидного синдрома (АФС).
Появление в крови ВА может говорить об аутоиммунных нарушениях (СКВ, АФС, ревматоидный артрит, язвенный колит, миелома и другие злокачественные новообразования), об осложнении после приема некоторых лекарств.
Исследование назначают при симптомах тромбоза глубоких вен (выраженных болях, отеках в ногах), при подозрении на тромбоэмболию (одышке, затруднении дыхания, кашле, наличии крови в мокроте, резкой боли в грудной клетке, учащении сердцебиения), при ДВС -синдроме и др.
Норма: 0 — 0,55 мкг FEU/мл. В период беременности, начиная с 13 недели, показатель постепенно повышается и к 35 неделям беременности может достигать 3,1 мкг FEU/мл
Повышение концентрации D-димера возможно при большом количестве тромбов в кровяном русле, недавно перенесенных хирургических операциях, травмах, сердечно-сосудистых заболеваниях, онкологических заболеваниях, ревматоидном артрите, заболеваниях печени, нормально протекающей беременности, у пожилых людей.

Волчаночный антикоагулянт (ВА) — группа антител, вырабатываемых иммунной системой против собственных фосфолипидов. ВА был впервые обнаружен у больных системной красной волчанкой (СКВ) (отсюда и название). ВА также может присутствовать у пациентов с аутоиммунными заболеваниями, больных СПИДом, при воспалениях, при онкологических заболеваниях, а также у тех, кто принимает фенотиазины, прокаинамид или фансидар.
Волчаночный антикоагулянт увеличивает риск появления тромбов в венах и артериях (чаще всего в венах ног – тромбоз глубоких вен). Такие тромбы способны блокировать ток крови в любой части тела, что может приводить к сердечным приступам, инфарктам, эмболии легких, а также к самопроизвольным абортам на поздних сроках.
Исследование назначают для выявления причин тромбоза, самопроизвольных выкидышей, при повышении АЧТВ, при диагностике антифосфолипидного синдрома (АФС).
Появление в крови ВА может говорить об аутоиммунных нарушениях (СКВ, АФС, ревматоидный артрит, язвенный колит, миелома и другие злокачественные новообразования), об осложнении после приема некоторых лекарств.
Антитромбин III (АТ III, АТ3) — специфический белок, задача которого блокировать факторы свертывания и не допускать повышенного образования кровяных сгустков (тромбов). Он замедляет действие нескольких коагуляционных факторов, предотвращая образование лишних тромбов. Существует два типа дефицита антитромбина III: вырабатывается нормальный антитромбин III, но в недостаточных количествах; либо он вырабатывается в достаточных количествах, но при этом дисфункционален. В том или ином случае при возникновении дефицита антитромбина III возникает риск развития тромбоза.
Дефицит антитромбина III может возникнуть в случаях наследственных заболеваний, заболеваний печени (цирроз, рак), заболеваний почек (сопровождающихся потерей белка с мочой), массивных тромбозов, хирургических вмешательств, употребления оральных контрацептивов, длительного введения гепарина, ДВС-синдрома, потери крови, онкологических заболеваний.
Повышенное содержание в крови антитромбина III может возникнуть в случаях длительного приема непрямых антикоагулянтов, дефицита витамина К, при заболеваниях печени (в т.ч. при острых вирусных гепатитах), воспалительных процессах, менструациях. При повышенном содержании в крови антитромбина III возникает риск кровотечений.
Исследование назначают при выявлении у пациента тромбоза, после удаления тромба и при отсутствующей реакции у пациента на терапию гепарином.
Норма содержания антитромбина III в крови взрослого человека — 83%-128% и может несколько отличаться у детей (особенно в период новорожденности) и беременных женщин.
Протеин S — кофактор протеина C, усиливающий его антикоагулянтное и профибринолитическое действие. Это витамин К — зависимый белок, синтезирующийся в печени. В крови он присутствует в двух формах — свободной и связанной. Биологическую активность проявляет только свободная форма, связанная форма функционально неактивна. Содержание протеина S зависит от пола, гормонального фона, меняется с возрастом.
Дефицит свободного протеина S может быть врождённым или приобретённым. Проявляется в виде тромбоэмболий в период новорожденности, детском и взрослом возрасте, во время беременности, на фоне приёма антикоагулянтов, при использовании оральных контрацептивов, у пациентов с патологией печени, а также при других клинических условиях.
Исследование проводят при подозрении на тромбофилию, в особенности у молодых людей, при тромбозах глубоких вен в молодом возрасте, артериальных тромбозах в молодом возрасте, при невынашивании беременности, при подготовке к беременности.
Норма протеина S: женщины: 54,7 – 123,7%, мужчины: 74,1 – 146,1%. У детей до 17 лет нормы протеина S варьируются в диапазоне от 15 до 140% (каждой возрастной группе свойственна своя норма протеина S).
Дефицит протеина S в крови может говорить о врождённом дефиците или дефекте протеина S, снижении синтетической функции печени, приёме лекарственных препаратов (антикоагулянты, оральные контрацептивы), беременности, острой фазе воспалительных заболеваний.

Протеин С (аутопротромбин IIА, фактор коагуляции XIV) — маркер противосвертывающей системы крови, поддерживающий ее в жидком состоянии. Образуется в печени из витамина К, циркулирует в крови в неактивном и активном состоянии. Участвует в разжижении крови, процессах отмирания клеток, действует как противовоспалительный агент. Дефицит протеина С повышает риск тромбозов и передается генетически. Мутаций протеина С известно более 200.
Анализ на протеин С назначается при наличии показаний (тромбозов), после получения результатов исследований гемостаза с выявленными отклонениями, а также если у прямого кровного родственника был установлен врожденный дефицит протеина С. Нормы протеина С в крови: активность протеина С — 70-130%, количество протеина С — более 3 мг/мл или 60 нмоль/л.
Кроме того, мы предложим Вам расширенные исследования генов системы гемостаза, в рамках которых мы сможем исследовать генетические факторы риска развития нарушений в системе свертывания крови. Данные исследования помогут понять, к развитию каких патологических состояний Вы предрасположены (инфаркты, инсульты, тромбоэмболии, кровотечения, патологии беременности и родов, осложнения послеоперационного периода и т.д.). По Вашему желанию исследования могут содержать заключение врача-генетика.
Сдаю анализы в этом медицинском центре уже несколько лет. Все в одном месте, быстро, без очередей, вежливо и грамотно. Претензий нет, результаты выдают вовремя, и даже оповестят и пригласят забрать анализ. Бывают приятные бонусы, что тоже не может не радовать. Всем рекомендую!друзьям и знакомым! Алина П.
Узнала случайно от знакомой, что в МЦРЗ можно обследоваться не только по гинекологии, а вообще любые анализы сдать. Для нас это — палочка-выручалочка! Живем рядом, обходим стороной очереди и инфекции в поликлиниках. Перед операцией сдала все анализы в один день и через несколько дней имела все на руках. Цены привлекательные, в прайсе есть все, что нужно! Анна Владимировна
Время, анонимность и комфорт для меня очень важны, поэтому я выбираю этот Медицинский центр. Очень приятно быть обслуженным на хорошем профессиональном уровне, а еще приятнее, когда это сделано быстро, без лишних разговоров и также быстро выдан результат. Процветания Вам! Андрей
Свертывание крови. Стадии гемостаза и факторы свертываемости
Гемостаз – это система, которая поддерживает жидкое состояние крови и предупреждает развитие кровотечений. Кровь осуществляет жизненно важные функции в организме человека, поэтому значительная потеря крови грозит нарушением работы всех органов и систем.
Система свертывания крови включает три составляющие:
- Собственно свертывающую систему – непосредственно осуществляет коагуляцию крови.
- Противосвертывающую систему – действие направлено на предотвращение сворачивания крови (патологического тромбообразования).
- Фибринолитическую систему – обеспечивает распад образовавшихся тромбов.
Свертывание крови – физиологический процесс, предотвращающий выход плазмы и клеток крови из кровеносного русла, путем поддержания целостности сосудистой стенки.
Учение о свертываемости крови сформировал А. Шмидт еще в прошлом столетии. При возникновении кровотечения активируются и участвуют в его остановке такие структуры как: эндотелий, факторы свертывания, форменные элементы, в большей мере тромбоциты. Для осуществления коагуляции крови нужны вещества, такие как кальций, протромбин, фибриноген.

Стадии первичного гемостаза (сосудисто-тробоцитарного)
Процесс свертывания крови начинается с включения сосудисто-тромбоцитарного этапа. Существует четыре стадии:
- Идет кратковременный спазм в сосудистом русле, который длится около 1 минуты. Диаметр просвета сужается на 30% под действием тромбоксана и серотонина, которые выделяются из активированных тромбоцитов.
- Адгезия тромбоцитов – начинается скапливание тромбоцитов возле поврежденного участка, они видоизменяются – меняют форму и формируют отростки, и способны прикрепится к сосудистой стенке.
- Агрегация тромбоцитов – процесс склеивания тромбоцитов друг с другом. Формируется неплотный тромб, способный пропускать плазму, как следствие все больше тромбоцитов наслаиваются на новообразованный тромб. Потом он уплотняется и плазма не проходит сквозь плотный сгусток – наступает необратимая агрегация тромбоцитов.
- Ретракция тромба – продолжающееся уплотнение тромботического сгустка.
Сосудисто-тромбоцитарный способ прекращения кровотечения – это первичный гемостаз, есть более сложный механизм свертывания крови – это вторичный гемостаз, происходит с помощью ферментных и неферментных веществ.
Стадии вторичного гемостаза
Существует 3 фазы свертывание крови на этапе вторичного гемостаза:
- Фаза активации – ферменты активируются, все заканчивается образованием протромбиназы и получением тромбина из протромбина;
- фаза коагуляция – формирование фибриновых нитей из фибриногена;
- фаза ретракции – идет образование плотного тромба.
Первая фаза свертывания крови
Плазменные факторы свертывания крови – совокупность неактивных ферментов и неферментных соединений, которые обитают в плазменной части крови и кровяных пластинках. Для свертывания крови помимо прочего необходимы ионы Са (IV) и витамин К.
Когда повреждаются ткани, разрываются сосуды, идет гемолиз клеток крови включается череда реакций с активацией ферментов. Начало активации обусловлено взаимодействием плазменных факторов свертывания с разрушенными тканями (внешний тип активации коагуляции), частями эндотелия и форменных элементов (внутренний тип активации коагуляции).
Внешний механизм
Из оболочки разрушенных клеток в кровяное русло попадает специфический белок – тромбопластин (III фактор). Он активирует VII фактор, присоединяя молекулу кальция, эта новообразованная субстанция воздействует на X фактор для последующей активации. После X фактор соединяется с тканевыми фосфолипидами и V фактором. Сформировавшийся комплекс за пару секунд преобразовывает долю протромбина в тромбин.
Внутренний механизм
Под действием разрушенного эндотелия или форменных элементов активируется XII фактор, который после воздействия кининогена плазмы активирует XI фактор. XI действует на IX фактор, который после перехода в активную фазу формирует комплекс: «коагуляционный фактор (IX) + Антигемофильный фактор В (VIII) + тромбоцитарный фосфолипид + ионы Са (IV)». Он активирует фактор Стюарта-Прауэра (X). Активированный X совместно с V и ионами Са действуют на фосфолипидную оболочку клетки и формируют новое образование – кровяную протромбиназу, которое обеспечивает переход протромбина в тромбин.
К плазменным факторам свертывания относятся неферментные белки – акселераторы (V, VII). Они нужны для эффективного и быстрого оседания крови, потому что ускоряют коагуляцию в тысячи раз.
Внешний механизм свертывания крови длится примерно 15 секунд, на внутренний приходится от 2 до 10 минут. Завершается эта фаза свертывания образованием тромбина из протромбина.
Протромбин синтезируется в печени, чтобы синтез осуществлялся нужен витамин К, который поступает с едой и накапливается в печеночной ткани. Таким образом, при поражении печени или недостатке витамина К, система свертывания крови не функционирует нормально, и часто возникает неконтролируемый выход крови из сосудистого русла.
Таблица факторов свертываемости крови
| Факторы свертывания крови | |
|---|---|
| Факторы | Свойства |
| I – фибриноген | Тромбин инициирует превращение первого фактора в фибрин |
| II – протромбин | Синтез в печени только совместно с витамином К |
| III – тромбопластин | При его участии протромбин преобразуется в тромбин |
| IV – ионы кальция | Нужны для активации факторов свертывания |
| V – проакцелерин | Стимулирует переход протромбина в тромбин |
| VI – сывороточный акцелератор | Инициирует переход протромбина в тромбин |
| VII – проконвертин | Действует на третий фактор (активация) |
| VIII – антигемофильный фактор А | Кофактор Х фактора |
| IX – антигемофильный фактор В (Кристмаса) | Активирует VIII и IV факторы |
| X – фактор Стюарта-Прауэра | Стимулирование протромбиназы |
| XI – предшественник тромбопластина | Активирует VIII и IX факторы |
| XII – фактор Хагемана | Берет участие в преобразовании прекалликреина в калликреин |
| XIII – фибрин- стабилизирующий фактор | Стабилизация сформировавшейся фибриновой массы |
Вторая фаза свертывания крови
Свертывание крови связано с переходом I фактора в нерастворимую субстанцию — фибрин. Фибриноген – гликопротеин, который при воздействии тромбина распадается на низкомолекулярное вещество — мономеры фибрина.
Следующий шаг образование неплотной массы – геля фибрина, из него формируется фибриновая сеть (белый тромб), нестабильная субстанция. Для ее стабилизации включается фибринстабилизирующий фактор (XIII) и тромб закрепляется в участке повреждения. Образованная сеть фибрина задерживает кровяные тельца — тромб становится красным.
Третья фаза свертывания крови
Ретракция кровяного сгустка идет при участии белка тромбостенина, Са, фибриновых нитей, актина, миозина, которые обеспечивают сжатие образованного тромба, тем самым предотвращают полную закупорку сосуда. После фазы ретракции восстанавливается кровоток по поврежденному сосуду, а тромб плотно прилегает и фиксируется к стенке.
Для предотвращения дальнейшего свертывания крови в организме активируется противосвертывающая система. Ее основные составляющие: нити фибрина, антитромбин III, гепарин.
К неповрежденным сосудам кровяные пластинки не адгезируются, этому способствуют сосудистые факторы: эндотелий, соединения гепарина, гладкость внутренней выстилки сосудов и др. Таким образом, в системе гемостаза поддерживается равновесие, и функционирование организма не нарушается.

Схема свертывания крови
Время свертывания крови в норме
Существует ряд методов определения время коагуляции. Для применения способа по Сухареву, каплю крови помещают в пробирку и ждут, когда она выпадет в осадок. При отсутствии патологии, продолжительность свертывания составляет 30 – 120 секунд.
Свертываемость по Дуке определяют следующим образом: производят прокол мочки уха и через 15 секунд промокают область прокола специальной бумагой. Когда кровь не будет появляться на бумаге, значит коагуляция произошла. В норме время свертывания по Дуке от 60 до 180 секунд.
При определении свертывания венозной крови пользуются методикой Ли-Уайта. Необходимо набрать 1 мл крови из вены и поместить в пробирку, наклонить под углом 50°. Проба заканчивается, когда кровь не вытекает из колбы. В норме продолжительность свертывания не должна превышать 4-6 минут.
Время свертывания может увеличиваться при геморрагическом диатезе, врожденной гемофилии, недостаточном количестве тромбоцитов, при развитии диссеминированного внутрисосудистого свертывания и других заболеваниях.
Факторы свертывания крови – значение и функции элементов, этапы коагуляции
Свертывание крови – многоступенчатый ферментный процесс, в котором участвуют различные факторы. Свертывание крови идет по двум механизмам: внутреннему, в котором наблюдается последовательная активация факторов XII, XI, IХ+VIII, Х+V и II, и по внешнему, который запускается поступлением в кровь извне тканевого фактора. Фактор III и фактор VIIа образуют активный комплекс, под влиянием которого активируются в присутствии ионов кальция и фосфолипидных мембран Х, V и II. Активированный фактор X переводит протромбин (фактор II) в тромбин (фактор IIа), ретроградно активируя комплекс фактор III-фактор VIIа. Жидкое состояние крови поддерживает система физиологических антикоагулянтов, в которую входят клеточные и гуморальные компоненты. Ее дополняет ферментная система, вызывающая прогрессирующее асимметричное расщепление фибриногена и фибрина, называемая фибринолитической или плазминовой системой.

Баркаган З.С., Момот А.П. Диагностика и контролируемая терапия нарушений гемостаза. – М.: Ньюдиамед, 2008. – 292 с.
Бессонова М.А. Становление гемостаза плода и новорожденного // Кремлевская медицина. Клинический вестник. – 2008. – № 1. – С. 56–61.
Глаголева Т.И., Завалишина С.Ю., Медведев И.Н. Выраженность противосвертывающей и фибринолитической активности сосудов у новорожденных телят с дефицитом железа, получавших ферроглюкин // Международный журнал прикладных и фундаментальных исследований. – 2013. – № 5. – С. 96–97.
Глаголева Т.И., Завалишина С.Ю., Медведев И.Н. Ферроглюкин и гамавит в коррекции антиагрегационных свойств сосудов у новорожденных телят с дефицитом железа // Успехи современного естествознания. – 2013. – № 5. – С. 17.
Завалишина С.Ю., Медведев И.Н., Краснова Е.Г. Влияние ферроглюкина и полизона на состояние коагуляционного гемостаза у новорожденных телят при анемии // Ветеринария. – 2009. – № 10. – С. 45–47.
Завалишина С.Ю. Активность свертывающей системы плазмы крови у здоровых телят в фазу молочно-растительного питания // Зоотехния. – 2010. – № 9. – С. 13–14.
Завалишина С.Ю. Коагуляционный гемостаз у телят в фазу молочного питания // Технология живых систем. – 2010. – Т. 7, № 4. – С. 61–65.
Завалишина С.Ю. Свертывающая активность плазмы крови у телят в период молочного кормления // Ветеринария. – 2010. – № 8. – С. 49–51.
Завалишина С.Ю., Медведев И.Н. Активность плазменного гемостаза у здоровых телят в фазу молочного питания // Международный журнал экспериментального образования. – 2010. – № 11. – С. 67–69.
Завалишина С.Ю. Динамика коагуляционного гемостаза у телят в фазу молочно-растительного питания // Вестник Российского университета дружбы народов. Серия: Экология и безопасность жизнедеятельности. – 2011. – № 1. – С. 22–27.
Завалишина С.Ю., Медведев И.Н. Коагуляционная активность плазмы крови и механизмы, ее ограничивающие, у телят в фазу молочного питания // Фундаментальные исследования. – 2012. – № 1–1. – С. 156–159.
Завалишина С.Ю., Медведев И.Н. Коагуляционный гемостаз у новорожденных телят с дефицитом железа, получавших ферроглюкин и гликопин // Фундаментальные исследования. – 2012. – № 9–3. – С. 555–558.
Завалишина С.Ю., Глаголева Т.И., Медведев И.Н. Сочетание ферроглюкина и крезацина в коррекции противосвертывающей и фибринолитической активности сосудов у новорожденных телят с дефицитом железа // Успехи современного естествознания. – 2013. – № 7. – С. 172.
Завалишина С.Ю. Состояние коагуляционно-сосудистых взаимодействий у новорожденных телят с дефицитом железа при внутримышечном введении ферроглюкина и гликопина // Доклады Российской академии сельскохозяйственных наук. – 2014. – № 1. – С. 57–59.
Краснова Е.Г., Медведев И.Н. Гемостатически значимая активность сосудов у поросят при потреблении растительных кормов // Сельскохозяйственная биология. – 2013.– № 2. – С. 88–92.
Краснова Е.Г., Медведев И.Н. Сосудистый контроль над гемостазом у поросят молочно-растительного питания // Актуальные вопросы ветеринарной биологии. – 2013.– № 2(18). – С. 8–12.
Кутафина Н.В., Медведев И.Н. Влияние физических нагрузок на систему гемостаза // Вестник Сургутского государственного педагогического университета. – 2014. – № 3. – С. 87.
Медведев И.Н., Краснова Е.Г., Завалишина С.Ю., Беспарточный Б.Д Способ нормализации уровня α2-антиплазмина у новорожденных поросят с анемией. Патент на изобретение RUS 2349308 01.10.2007.
Медведев И.Н., Краснова Е.Г., Завалишина С.Ю., Беспарточный Б.Д. Способ ускоренной нормализации тромбопластинообразования у новорожденных поросят с анемией. Патент на изобретение RUS 2349327 24.10.2007.
Медведев И.Н., Краснова Е.Г., Завалишина С.Ю., Беспарточный Б.Д. Способ коррекции гиперфибриногенемии у новорожденных поросят с анемией. Патент на изобретение RUS 2349310 24.10.2007.
Медведев И.Н., Краснова Е.Г., Завалишина С.Ю., Беспарточный Б.Д. Способ оптимизации активности протеина С у новорожденных поросят с анемией. Патент на изобретение RUS 2350318 01.10.2007.
Медведев И.Н., Краснова Е.Г., Завалишина С.Ю., Беспарточный Б.Д. Способ оптимизации уровня фибриногенемии у новорожденных поросят с анемией. Патент на изобретение RUS 2350320 24.10.2007.
Медведев И.Н., Кумова Т.А., Беспарточный Б.Д. Способ нормализации уровня ингибитора активатора плазминогена при метаболическом синдроме. Патент на изобретение RUS 2345770 09.07.2007.
Медведев И.Н., Кумова Т.А., Беспарточный Б.Д. Способ нормализации тромбопластинообразования у больных метаболическим синдромом. Патент на изобретение RUS 2345771 19.06.2007.
Медведев И.Н., Завалишина С.Ю., Левкова Н.А., Карцева Т.И., Киперман Я.В. Нарушения в системе гемостаза у новорожденных телят // Ветеринария. – 2008. – № 8. – С. 44–47.
Медведев И.Н., Завалишина С. Плазменный гемостаз у новорожденных телят и роль корректоров при его нарушении // Зоотехния. – 2009. – № 2. – С. 9–11.
Медведев И.Н., Завалишина С.Ю. Способ нормализации активности антитромбина III в крови у новорожденных телят с железодефицитной анемией. Патент на изобретение 2472500 05.05.2012.
Медведев И.Н., Завалишина С.Ю. Активность системы гемостаза у телят молочно-растительного питания // Доклады Российской академии сельскохозяйственных наук. – 2012. – № 6. – С. 62–65.
Медведев И.Н., Завалишина С.Ю. Динамика активности системы гемостаза у молодняка крупного рогатого скота в раннем онтогенезе // Зоотехния. – 2013. – № 11. – С. 20–21.
Медведев И.Н., Парахневич А.В. Коагуляционные характеристики крови у подсосных свиноматок в экологических условиях Центральной России // Вестник Российского университета дружбы народов. Серия: Экология и безопасность жизнедеятельности. – 2013. – № 4. – С. 21–24.
Парахневич А.В., Максимов В.И., Медведев И.Н. Активность системы коагуляции крови у свиноматок после отъема, содержащихся в условиях Центральной России // Вестник АПК Ставрополья. – 2013. – № 1(9). – С. 141–143.
Чупрова А.В. Клиническое значение мембранной активации свертывания крови у новорожденных // Педиатрия. – 1998. – № 5. – С. 7–10.
Чупрова А.В., Белоусова Т.В. Диссеминированное внутрисосудистое свертывание крови у детей. – М., 2004. – 158 с.
Шабалов Н.П., Иванов Д.О., Шабалова Н.Н. Гемостаз в динамике первой недели жизни как отражение механизмов адаптации к внеутробной жизни новорожденного // Педиатрия. – 2000. – № 3. – С. 84–91.
Шабалов Н.П., Иванов О.Д., Шабалова Н.П. Особенности ДВС-синдрома при различных формах перинатальной патологии // Клиническая патофизиология. – 2002. – Т. 1, № 3. – С. 81–88.
Medvedev I.N., Zavalishina S.Yu. Hemostatic system activity in milk-and plant-fed calves // Russian Agricultural Sciences. – 2013. – Т. 39, № 1. – С. 74.
Свертывание крови – многоступенчатый ферментный процесс, в котором участвуют белки-протеазы, неферментные белковые акцелераторы процесса и конечный субстратный белок – фибриноген [7, 11]. Важной особенностью гемокоагуляционного каскада является то, что активация и взаимодействие факторов свертывания крови почти на всех этапах процесса происходят на свободных плазменных фосфолипидных мембранах [28]. Такой способностью к фиксации и активации факторов свертывания обладают обращенные к наружной стороне мембраны головки отрицательно заряженных фосфолипидов – фосфатидилсерина, фосфатидилэтаноламина и др. [10, 15, 22]. Ряд видов гиперкоагуляции связан с избытком в плазме крови фосфолипидных мембран, причем удаление последних без каких-либо других воздействий позволяет переводить повышенную свертываемость крови в пониженную [29].
Свертывание крови может функционировать по внутреннему механизму, в котором наблюдается последовательная активация факторов XII, XI, IХ + VIII, Х + V и II и по внешнему (быстрому), который запускается поступлением в кровь извне тканевого фактора (фактор III) [36]. Фактор III и фактор VIIа образуют активный комплекс, под влиянием которого активируются в присутствии ионов кальция и фосфолипидных мембран Х, V и II. Активированный фактор X не только переводит протромбин (фактор II) в тромбин (фактор IIа), но ретроградно активирует комплекс фактор III-фактор VIIа. Оба пути замыкаются на факторе X, вслед за чем они смыкаются и вплоть до образования фибрина сливаются в единый поток. Однако внешний и внутренний механизмы начального этапа свертывания крови не обособлены полностью друг от друга. Они взаимодействуют между собой путем взаимной активации факторов XII и VII, VII и IX. Фактор Ха ретроградно активирует фактор VII в комплексе с фактором III и Са 2+ [12, 13, 25].
Удлинение или укорочение протромбинового времени при нормальных показаниях тромбинового теста (отражающий переход фибриногена в фибрин при добавлении тромбина) может быть обусловлено дефицитом или избытком факторов VII, X, V и II, причем нарушение только в этом тесте при нормальных показаниях всех других коагуляционных проб может быть связано только с колебанием уровня фактора VII [20, 26].
При этом, внутренний механизм начального этапа свертывания крови реализуется цепной (каскадной) реакцией, в которую последовательно включаются факторы XII, XI, IX и VIII. Активация по этому пути инициируется контактом крови (плазмы) с субэндотелием, особенно коллагеном, что ведет к образованию активного «контактного» комплекса, в который входят фактор ХIIа-калликреин-фактор ХIа [31].
Cвертывание по внутреннему механизму оценивается путем определения общего времени свертывания крови (от момента извлечения ее из сосудистого русла до образования сгустка в пробирке), но намного более точно – по активированному частичному (парциальному) тромбопластиновому времени (АЧТВ или АПТВ). В этом тесте усиливаются и стандартизируются контактная (добавлением каолина) и фосфолипидная (добавлением кефалина) активация процесса свертывания. Этой же цели служит так называемый «аутокоагуляционный тест» (АКТ), отражающий кинетику образования и инактивации тромбина в исследуемой плазме при стандартизированной гемолизатом эритроцитов контактной и фосфолипидной активации процесса свертывания [1, 4, 24].
Трансформация протромбина в тромбин реализуется протромбиназным комплексом, в котором активным началом является фактор Xа, а акцелератором процесса – фактор Vа [14]. При этом от протромбина отщепляются фрагменты 1 + 2, после чего одноцепочная молекула протромбина трансформируется вначале в мейзотромбин, а затем в двухцепочный активный фермент – тромбин (фактор IIа). Активация фактора X на фосфолипидной мембране резко ускоряется Ас-глобулином (фактором V), который, как и фактор VIII, активируется по механизму обратной связи первыми небольшими дозами тромбина [19, 30].
Конечная фаза свертывания крови, как известно, характеризуется трансформацией растворенного в плазме фибриногена в волокна фибрина, которые образуют основной каркас сгустка крови [5].
В системе свертывания крови действуют силы не только самоускорения, но и последующего самоторможения, в силу чего факторы свертывания крови и их метаболиты приобретают антикоагулянтные свойства. Так, например, фибрин связывает и инактивирует большие количества тромбина и фактора Ха. Тормозят конечный этап свертывания и продукты расщепления фибриногена плазмином [3, 8].
Значительная часть тромбина, образующегося при активации свертывающей системы крови, связывается с тромбомодулином сосудистой стенки и утрачивает при этом способность вызывать образование фибрина и активировать фактор XIII. Вместе с тем такой заблокированный тромбомодулином тромбин сохраняет способность активировать систему важнейших антикоагулянтов – протеинов С и S, вызывать через них активацию фибринолиза. Поэтому тромбин трансформируется в мощный противотромботический агент [21]. В процессе постоянной слабой активации свертывающей системы крови, носящей в организме перманентный характер, фактически весь образующийся тромбин связывается с тромбомодулином и, не вызывая гемокоагуляции, поддерживает в активном состоянии указанный выше противосвертывающий механизм и жидкое состояние циркулирующей крови [16].
Важнейшую роль в поддержании жидкого состояния крови играет система физиологических антикоагулянтов, в которую входят клеточные и гуморальные компоненты [17]. К клеточным компонентам, обеспечивающим поддержание крови в жидком состоянии в циркуляции, прежде всего, относятся клетки РЭС и гепатоциты, которые специфически удаляют активированные факторы свертывания крови и фибриноген без какого-либо влияния на их предшественники. Гуморальный компонент состоит из физиологических антикоагулянтов, которые тем или иным путем инактивируют (ингибируют) активные факторы свертывания крови. Среди них наиболее значимыми для практики являются антитромбин III, протеины С и S. Антитромбин III инактивирует сериновые протеазы, а именно, тромбин и все предшествующие его образованию активные факторы (за исключением факторов VIIIа и Vа), путем образования с ними неактивных комплексов [27]. Инактивация факторов VIIIа и Vа – сильнейших катализаторов образования тромбина – осуществляется другими белками, так называемой системой протеинов С и S, которая активируется комплексом, образующимся при взаимодействии тромбина с тромбомодулином (специфическим рецептором сосудистой стенки). Активированный этим комплексом плазменный протеин С в присутствии своего кофактора – протеина S – протеолитически расщепляет факторы VIIIа и Vа и таким образом прерывается реакция образования активного фактора X и тромбина [6, 9].
Указанные антикоагулянты синтезируются в печени. Но в отличие от антитромбина III, синтез протеинов С и S зависит от витамина К [134], при дефиците которого могут развиться рецидивирующие тромбозы. Снижение уровня естественных антикоагулянтов, как правило, сопровождает венозные тромбозы и может быть как следствием генетических нарушений (врожденные тромбофилии), так и результатом их потребления, например, во время диссеминированного внутрисосудистого свертывания крови [21].
Ферментная система, вызывающая прогрессирующее асимметричное расщепление фибриногена и фибрина, обозначается как фибринолитическая или плазминовая система. Главным действующим началом этой системы является протеолитический фермент – плазмин, содержащийся в плазме в виде профермента (плазминогена). В циркулирующей крови плазминоген встречается в двух разных формах – в виде интактного глу-плазминогена и в виде частично подвергшегося протеолизу – лиз-плазминогена, который в 10–20 раз быстрее трансформируется в активный плазмин [13].
Основными активаторами внешнего механизма являются тканевой плазминогеновый активатор (ТПА), на долю которого приходится около 70 % общей активаторной активности. Другие активаторы – продуцируемая в юкст-гломерулярном аппарате почек урокиназа и активаторы из других тканей и клеток крови (моноцитов, тромбоцитов и др.).
Внутренняя активация плазминогена частично осуществляется комплексом фактора XIIа с калликреином (так называемый «XIIа-зависимый фибринолиз») и частично – другими механизмами, в том числе антикоагулянтным комплексом «протеины С + S» [1].
Противостоит фибринолизу ингибиторная система, важнейшими компонентами которой являются ингибиторы тканевого активатора плазминогена, обозначаемые как РАI-1 и РАI-2, антиплазмины (в том числе самый мощный из них – α2-антиплазмин) и ингибиторы трансформации плазминогена в плазмин [10]. Более слабым ингибиторным действием обладают α2-макроглобулин, Сl-эстеразный ингибитор, антитрипсин, антитромбин III и др. [18, 23].
При изучении системы гемостаза здоровых плодов путем кордоцентеза в зависимости от гестационного возраста не выявлено достоверно значимых различий среди показателей антикоагулянтной системы и системы фибринолиза при сроке гестации 20–23 недели и 24–28 недель [2]. При этом отмечена тенденция к увеличению уровня относительно низких показателей: протеина С, плазминогена, α2-антиплазмина и ингибитора активатора плазминогена по мере увеличения гестационного возраста, что может считаться физиологической динамикой состояния системы гемостаза здоровых плодов [2, 32].
В то же время в литературе есть данные [35], в которых также проводилось исследование плодовой крови, полученной методом кордоцентеза, о более значимых различиях в уровнях ингибиторов свертывания в зависимости от сроков гестации. Эти авторы утверждают о достаточном физиологическом повышении данных показателей гемостаза при увеличении гестационного возраста.
Однако в любом случае к концу гестационного периода в норме повышаются уровни физиологических антикоагулянтов: антитромбина III и протеина С. К рождению в системе фибринолиза нарастает активность плазиногена и ингибитора активатора плазминогена. Уровень α2-антиплазмина при рождении увеличивается незначительно по отношению к уровню плодов, а концентрация Д-димера в крови новорожденных может в ряде случаев превышать таковую, характерную для взрослых [34].
Есть мнение, что тромбогенную направленность гемостаза при рождении могут обуславливать высокий уровень фактора Виллебранда, повышенные концентрации факторов V и XII, обуславливающие активацию внутреннего пути коагуляции. В то же время в начале фазы новорожденности нередко наблюдается относительно низкое содержание продуктов деградации фибрина/фибриногена [33].
Высокая прокоагулянтная активность может в скорости снижаться во многом за счет понижения содержания печеночных факторов свертывания, вероятно, вследствие их потребления в ходе активного фибринолиза. Есть мнение, что в начале фазы новорожденности есть место повышенному содержанию продуктов деградации фибрина, что дополнительно препятствует развитию тромбоза [33, 35].
Имеются отдельные сведения, что на 3-и сутки жизни у разных биологических объектов отмечается максимальный разброс активности: VII,VIII, IX, XII факторов, антитромбина III, протеина C, α1-антитрипсина с усилением общей гипокоагуляционной тенденции, обеспечивая гемоциркуляцию, являясь биологически целесообразной.
Есть мнение, что к первым 5–7 дням жизни у здоровых новорожденных наблюдается облигатное снижение в плазме уровня витамин-К-зависимых факторов свертывания с развитием физиологической гипокоагуляции, сопряженной с транзиторным дефицитом антитромбина III, протеинов C, S и основных компонентов фибринолиза – плазминогена и его активаторов [2, 7].
Таким образом, имеющиеся сведения о функционировании системы свертывания и систем, ее лимитирующих, на протяжении фазы новорожденности остаются исследованы весьма недостаточно. Не выявлена динамика активности этих систем при развитии дисфункций у новорожденных и не найдены эффективные подходы для их оптимизации.
Система гемостаза

Равновесие между свертывающими и противосвертывающими процессами в крови – необходимое условие существования нашего организма. Нарушение этого равновесия приводит к тяжелым последствиям: кровотечению или тромбообразованию. Поддерживается данный баланс системой гемостаза – одной из важнейших функциональных систем организма, которая решает две «противоположные» задачи:
• поддерживает жидкое состояние крови в обычных условиях;
• останавливает кровотечение при повреждении сосуда.
Свёртывающая система крови (гемостаз) нужна для остановки кровотечения, чтобы избежать значительных кровопотерь при повреждении сосудов. Механизмы гемостаза реализуются при любом повреждении эндотелия сосудистой стенки, вызванном физическими, гемодинамическими, химическими факторами, а также воспалительными процессами, действием иммунных комплексов, нарушением метаболизма (атеросклероз, коллагенозы) и др.
Свертывание крови является жизненно необходимым: мутации в генах основных белков свертывания, как правило, летальны. Система гемостаза удерживает абсолютное первенство среди множества систем нашего организма как главная непосредственная причина летальных исходов: люди болеют разными болезнями, но умирают почти всегда от нарушений системы свертывания крови.

Если причина известна, почему же с ней нельзя бороться? Разумеется, бороться можно и нужно: постоянно создаются новые методы диагностики и терапии нарушений системы свертывания. Но проблема заключается в том, что свертывание крови — крайне сложный и во многом еще загадочный биохимический процесс, который запускается при повреждении кровеносной системы и ведет к превращению жидкой плазмы крови в студенистый сгусток, который как пробка затыкает рану и останавливает кровотечение.
Система гемостаза состоит из десятков белков, которые взаимодействуют в сотнях реакций друг с другом, со стенками сосудов, с клетками крови. Нарушения этой системы крайне опасны и могут привести к кровотечению, тромбозу или другим патологиям, которые совместно отвечают за львиную долю смертности и инвалидности в современном мире. Здесь мы рассмотрим устройство этой системы и расскажем о самых современных методах ее исследования.
I. Система свертываемости крови
По современным представлениям, в остановке кровотечения задействованы:
1) сосудисто-тромбоцитарный гемостаз (первичный), в котором принимают участие стенки сосудов, тромбоциты и, отчасти, эритроциты;
2) плазменный гемостаз (вторичный) – когда в процесс свертывания крови включаются белки плазмы (плазменные факторы свертывания крови).
Такое деление гемостаза достаточно условно, так как в организме эти два звена свертывающей системы крови тесно взаимосвязаны.
1. Первичный гемостаз (сосудисто-тромбоцитарный)
Обеспечивает остановку кровотечения из мелких сосудов и сосудов с низким артериальным давлением.
Триггер – повреждение сосудистой стенки и обнажение волокон коллагена – запускает события, которые следуют одно за другим следующим образом.

Реакция кровеносного сосуда
1) Спазм – моментальное рефлекторное сужение сосуда.
Реакция тромбоцитов
2) Адгезия – тромбоциты, благодаря наличию рецепторов к коллагену, прилипают к внутренней стенке сосуда в месте повреждения. Такая стабилизация не дает току крови смывать сгусток тромбоцитов со стенки сосуда.
3) Активация – форма тромбоцитов изменяется, на их поверхности образуются отростки.
4) Агрегация – тромбоциты в большом количестве слипаются, набухают и образуют все более крупный агрегат – рыхлый тромбоцитарный сгусток.
Таким образом, место повреждения сосуда закрывается очень плотной многослойной пробкой (белый тромб), который формируется в течение 3-5 минут. Обычно этого достаточно, чтобы остановить кровотечение у здорового человека при повреждении мелких сосудов.
Таким образом, первичный гемостаз обусловлен сужением сосудов и их механической закупоркой агрегатами тромбоцитов.
 | Единичный тромбоцит в активированном состоянии с отростками |
 | |
| Тромбоцитарный сгусток | |
 |
2. Вторичный гемостаз (плазменный, коагуляция)
Первичный белый тромб – это только временное решение, так как достаточно резкого движения или даже незначительных колебаний артериального давления (например, при физическом напряжении), чтобы сорвать тромбоцитарную пробку с места повреждения сосудистой стенки. Необходим дополнительный механизм, который укрепит скопление тромбоцитов и плотно свяжет его с краями раны. Начинается вторичный гемостаз, или собственно свертывание крови – коагуляция.
При свертывании крови запускается каскад реакций, превращающих растворенный в плазме белок фибриноген в нерастворимый фибрин, который формирует подобие тонкой сетки. Сеть фибрина захватывает находящиеся рядом лейкоциты и эритроциты, формирует красный тромб, уплотняет его и прикрепляет к краям раны. Коагуляция, или свертывание крови, останавливает кровотечение из крупных сосудов и предотвращает его возобновление. В коагуляционном каскаде реакций участвуют особые белки плазмы — факторы свертывания крови, которые обозначаются римскими цифрами в порядке их открытия (например, фактор II, VII и т.д.). Таким образом, в норме скорость свертывания крови зависит от взаимодействия целого ряда различных факторов.


3. Фибринолиз (растворение сгустка крови)
Система фибринолиза восстанавливает проходимость сосудов после ремонта места повреждения сосудистой стенки. Расщепление фибрина происходит под действием специального фермента – плазмина – с образованием продуктов деградации фибрина (ПДФ). Процесс фибринолиза длится от дней до недель, в зависимости от размера и выраженности повреждения сосуда.

II. Алгоритм диагностики нарушений системы гемостаза

Нарушения в системе свертываемости могут приводить к серьезным, с угрозой жизни, кровотечениям и тромбозам.
Которые, в конечном итоге, являются прямой или косвенной причиной наступления более половины всех летальных исходов: например, тромбозы при травме, сепсисе, онкологическом заболевании, хирургическом вмешательстве и др.
Поэтому своевременная точная оценка состояния системы гемостаза – одна из важнейших задач медицины.

1. Скрининг
Первоначально выполняются исследования, отражающие состояние целых звеньев системы гемостаза.
Для этого существует стандартный набор тестов, традиционно называемых скрининговыми:
• время кровотечения
• протромбиновое время (ПВ)
• международное нормализованное отношение (МНО)
• активированное частичное тромбопластиновое время (АЧТВ)
• тромбиновое время (ТВ)
• растворимые фибрин-мономерные комплексы (РФМК)
Диагностическая значимость скрининга:
• нормальные результаты – нет значительных изменений в системе гемостаза
• аномальные результаты – показывают направленность нарушений в системе гемостаза
Протромбиновое время (ПВ) – один из основных базовых тестов в повседневной клинической практике; используется для определения времени свертывания и расчета МНО. Кровь собирают в пробирку с цитратом натрия, который действует как антикоагулянт: связывает ионы кальция, без которых кровь не свертывается. Избыток кальция возвращает цитратной плазме способность к свёртыванию. Далее к плазме с кальцием добавляется тканевой фактор (III фактор свертывания), и измеряется время образования сгустка.
Международное нормализованное отношение (МНО) – результаты ПВ зависят от активности используемого в тесте реагента тромбопластина. Чтобы уйти от этой зависимости и стандартизовать измерения ПВ, был введён показатель МНО, который рассчитывается как отношение (ПВ пациента/ПВ норма)МИЧ. Где МИЧ – это международный индекс чувствительности тромбопластина, показывающий его активность для данной партии реагента.
Активированное частичное тромбопластиновое время (АЧТВ) – представляет собой время, за которое формируется сгусток в образце плазмы крови, после добавления к ней специальных активаторов этого процесса. Таким образом, оценивается степень воздействия факторов свертывания крови на образование тромба.
III. Методы исследования системы свертывания
Клоттинговый (англ. «сlot» – сгусток) – в пробе запускается процесс
свертывания, и определяется время образования сгустка
(механическим или оптическим способом).
Работа любого коагулометра основывается на способе регистрации времени образования фибринового сгустка – механическом или оптическом.
IV. Способы исследования системы свертывания

1) Механический способ – время образование сгустка определяется по изменению вязкости реакционной смеси:
• в реакционную кювету помещается металлический шарик;
• вокруг кюветы создаётся вращающееся магнитное поле;
• шарик вращается в магнитном поле со строго фиксированной скоростью или совершает колебательные движения с фиксированной амплитудой;
• при формировании сгустка вязкость пробы растет, движение шарика замедляется;
• прибор регистрирует изменение скорости движения шарика;
• остановка шарика приводит к автоматической остановке секундомера коагулометра.
ВАЖНО! Результат механического измерения не зависит от оптической плотности пробы , поэтому в качестве образца можно использовать как цитратную плазму, так и цельную кровь , в том числе, капиллярную.
ВАЖНО! Благодаря тому, что оптическая плотность пробы не влияет на результат механического измерения, можно исследовать «сложные» пробы (иктеричные, липемичные и гемолизные), без их отбраковки и повторных назначений. Доступно только для механического способа измерения.
Механика прощает ошибки преаналитического этапа.

Что такое иктеричност ь?
Иктеричная проба окрашена в ярко-желтый цвет из-за высокой концентрации билирубина в крови, которая чаще всего обусловлена различными заболеваниями печени, а также приемом некоторых лекарственных препаратов. Высокая концентрация билирубина в пробе может исказить значение лабораторного показателя. Предсказать иктеричность образца, как правило, невозможно. При этом не всегда возможно и скорректировать повышенный уровень билирубина в крови пациента. Чтобы выполнить анализ иктеричной пробы и получить достоверный результат, необходимо использовать соответствующие способы и оборудование, которые позволяют исследовать иктеричную пробу без определения оптической плотности – на механических коагулометрах.

Что такое липемия?
Липемичная проба имеет желтовато-белый цвет из-за высокой концентрации липидов (жиров) в крови. Чаще всего липемия обусловлена приемом жирной пищи незадолго до сдачи крови, а также некоторыми нарушениями обмена веществ, в частности, обмена жиров. Высокая концентрация жиров в крови может исказить значение лабораторного показателя. Как избежать влияния липемии на результат? Если нарушены правила подготовки к сдаче анализов, кровь можно пересдать. Но если липемия обусловлена нарушениями метаболизма, «улучшить» образец невозможно в принципе. Чтобы выполнить анализ такой пробы и получить корректный результат, необходимо использовать соответствующие способы и оборудование (без определения оптической плотности), которые позволяют исследовать мутную пробу.
ВАЖНО! Если аномальная окраска плазмы обусловлена, например, приемом лекарств, то новое взятие образца ситуацию с качеством пробы не улучшит. Для таких пациентов получение результата возможно только механическим способом. Таким образом, только механика даст корректный результат для «сложной» пробы, качество которой улучшить слишком затратно или вообще невозможно.
| ВАЖНО! Особенности механических коагулометров позволяют успешно применять их для оценки гемостаза как в рутинном скрининге, так и в педиатрической практике и при контроле лечения непрямыми антикоагулянтами. |  |
2) Оптический способ – детекция сгустка по изменению оптической плотности пробы:

• Исходная плазма прозрачна
• Формирование сгустка уменьшает
светопропускание через кювету
• Уменьшение светопропускания фиксируется
оптической системой прибора
ВАЖНО! Результат оптического измерения зависит от оптической плотности пробы, поэтому в качестве образца нельзя использовать цельную кровь, можно использовать только плазму. По этой же причине сложные пробы отбраковываются, а используемые реагенты должны быть прозрачными.
Оптический способ имеет лучшую чувствительность при замедленном образовании сгустка, при низком уровне фибриногена, на фоне антикоагулянтной терапии и в случае, если колебания шарика рвут слабые нити фибрина. С другой стороны, при скрининговых исследованиях (область использования полуавтоматических коагулометров) доля пациентов с такими особенностями свертывающей системы очень мала. Они обычно наблюдаются в специализированных клиниках, с другим парком оборудования и набором тестов. Поэтому вышеупомянутая особенность оптического метода не дает какого-либо ключевого преимущества в сравнении с механическим методом в области применения полуавтоматических коагулометров.


